Fonte: www.livescience.com/educar.sc.usp.br/www.chem4kids.com
Leia mais em: https://www.portalsaofrancisco.com.br/quimica/materia-e-energia

Unidades de medida para a densidade
A unidade de medida da densidade, no Sistema Internacional de Unidades, é o quilograma por metro cúbico (kg/m3), embora as unidades mais utilizadas sejam o grama por centímetro cúbico (g/cm3) ou o grama por mililitro (g/mL). Para gases, ela costuma ser expressa em gramas por litro (g/L).
Conforme se observa na expressão matemática da densidade, ela é inversamente proporcional ao volume. Isso significa que, quanto menor o volume ocupado por determinada massa, maior será a densidade.
Um exemplo que nos mostra isso é a água. Quando a água está sob a temperatura de aproximadamente 4ºC e sob pressão ao nível do mar, que é igual a 1,0 atm, a sua densidade é igual a 1,0 g/cm3. No entanto, no estado sólido, isto é, em temperaturas abaixo de 0ºC, ao nível do mar, a sua densidade mudará – ela diminuirá para 0,92 g/cm3.
.jpg)
Observe que o gelo flutua quando colocado na água e afunda quando colocado em bebidas alcoólicas. A densidade é a grandeza que explica esse fato. Conforme já dito, a densidade do gelo (0,92 g/cm3) é menor que a da água (1,0 g/cm3); já a densidade do álcool é de 0,79 g/cm3, o que significa que é menor que a densidade do gelo, por isso, o gelo afunda.

A maior parte de um iceberg está submersa
Alumínio ................................ 2,70 g/cm3
Diamante .................................3,5 g/cm3
Chumbo...................................11,3 g/cm3
Mercúrio .................................13,6 g/cm3
Por Jennifer Fogaça
Graduada em Química
Substância
|
Densidade
|
Mercúrio
|
13,546
|
Ácido sulfúrico
|
1,841
|
Água
|
1,00
|
Ferro
|
7,86
|
Alumínio
|
2,702
|
Chumbo
|
11,3
|
Cobre
|
8,9
|
Ouro
|
19,3
|
Metanol
|
0,79
|
2)Calcular a densidade do mercúrio, sabendo que 1360 gramas ocupam o volume de 100 cm3.
D=m/v 1360g/100cm3 = D= 13,6 g/cm3
A história dos Modelos atômicos
Modelos
Atômicos
Relembrando: O que é matéria?
Matéria é tudo aquilo que tem massa e ocupa um lugar no espaço, ou seja, a matéria apresenta volume e massa. São exemplos de matéria: as árvores, as estrelas, o ar, uma cadeira, uma bicicleta, etc. A matéria é formada a partir da combinação de elementos químicos, iguais ou diferentes, que são constituídos de partículas: prótons, elétrons e nêutrons. A combinação dessas três partículas forma os átomos, que ao se unirem por ligações químicas, constituem a diversidade de materiais que conhecemos.
Os
modelos atômicos são os aspectos estruturais dos átomos
que foram apresentados por cientistas, na tentativa de compreender melhor o
átomo e a sua composição. Em 1808, o cientista inglês John Dalton propôs uma
explicação para a propriedade da matéria. Trata-se da primeira teoria atômica
que dá as bases para o modelo atômico conhecido atualmente. A constituição da
matéria é motivo de estudos desde a antiguidade. Os pensadores Leucipo (500
a.C.) e Demócrito (460 a.C.) formularam a ideia de haver um limite para a pequenez
das partículas. Eles afirmavam que elas se tornariam tão pequenas que não
poderiam ser divididas. Chamou-se a essa partícula última de átomo. A palavra é
derivada dos radicais gregos que, juntos, significam o que não se pode dividir.
Disponível
em: <https://www.docsity.com/pt/o-atual-modelo-atomico/4732070/>. Acesso em
09/05/2021.
|
|
O
Modelo Atômico de Dalton: Conhecido como o modelo bola de bilhar,
possui os seguintes princípios:
• Todas as substâncias são formadas de pequenas partículas chamadas átomos;
• Os
átomos de diferentes elementos têm diferentes propriedades, mas todos os átomos
do mesmo elemento são exatamente iguais;
• Os
átomos não se alteram quando formam componentes químicos;
• Os
átomos são permanentes e indivisíveis, não podendo ser criados nem destruídos;
as reações químicas correspondem a uma reorganização de átomos.
Disponível
em:< https://commons.wikimedia.org/wiki/File:Atomo_de_Dalton.jpg> Acesso
em: 09/05/2021.
|
|
Modelo
Atômico de Thomson: Joseph John Thomson (1856-1940) foi o primeiro
a comprovar a divisibilidade do átomo. Ao pesquisar sobre raios catódicos, o
físico inglês propôs esse modelo que ficou conhecido como o modelo pudim de
ameixa. Ele demonstrou que esses raios podiam ser interpretados como sendo um
feixe de partículas carregadas de energia elétrica negativa. Em 1887, Thomson
sugeriu que os elétrons eram um constituinte universal da matéria. Ele
apresentou as primeiras ideias relativas à estrutura interna dos átomos.
Thomson, indicava que os átomos deviam ser constituídos de cargas elétricas
positivas e negativas distribuídas uniformemente. Ele descobriu essa mínima
partícula e assim, estabeleceu a teoria da natureza elétrica da matéria.
Concluiu que os elétrons eram constituintes de todos os tipos de matéria, pois
observou que a relação carga/massa do elétron era a mesma para qualquer gás
empregado em suas experiências. Em 1897, Thomson tornou-se reconhecido como o
“pai do elétron”.
Disponível
em: < https://commons.wikimedia.org/wiki/File:%C3%81tomo_Thomson.png >
Acesso em 09/05/2021.
|
|
Modelo atômico de Rutherford: Em 1911, o físico neozelandês Rutherford colocou uma folha de ouro bastante fina dentro de uma câmara metálica. Seu objetivo era analisar a trajetória de partículas alfa a partir do obstáculo criado pela folha de ouro. Nesse ensaio de Rutherford, observou que algumas partículas ficavam totalmente bloqueadas e outras partículas, que não eram afetadas, ultrapassavam a folha sofrendo desvios. Segundo ele, esse comportamento podia ser explicado graças às forças de repulsão elétrica entre essas partículas. Pelas observações, afirmou que o átomo era nucleado e sua parte positiva se concentrava num volume extremamente pequeno, que seria o próprio núcleo. O Modelo Atômico de Rutherford, conhecido como modelo planetário, corresponde a um sistema planetário em miniatura, no qual os elétrons se movem em órbitas circulares, ao redor do núcleo.
Disponível em: < https://commons.wikimedia.org/wiki/File:%C3%81tomo_de_Rutherford.png> Acesso em 09/05/2021.
|
|
Modelo de Rutherford – Bohr: O
modelo apresentado por Rutherford foi aperfeiçoado por Bohr. Por esse motivo, o
aspecto da estrutura atômica de Bohr também é chamado de Modelo Atômico de Bohr
ou Modelo Atômico de Rutherford-Bohr. A teoria do físico
dinamarquês Niels Bohr estabeleceu as seguintes concepções atômicas:
• Os elétrons que giram ao redor do núcleo
não giram ao acaso, mas descrevem órbitas determinadas.
• O átomo é incrivelmente pequeno, mesmo
assim a maior parte do átomo é espaço vazio. O diâmetro do núcleo atômico é
cerca de cem mil vezes menor que o átomo todo. Os elétrons giram tão depressa
que parecem tomar todo o espaço.
• Quando a eletricidade passa através do
átomo, o elétron pula para a órbita maior e seguinte, voltando depois à sua
órbita usual.
• Quando os elétrons saltam de uma órbita para a outra resulta luz.
Disponível
em: < https://static.todamateria.com.br/upload/ru/th/rutherforborh-cke.jpg>
Acesso em 06/05/2021.
Click Aki 👉Átomos (Características do átomo)
Organização da Tabela Periódica Atual


RÚSSIA- CIRCA 2009: Selo impresso na Rússia que mostra Dmitri Mendeleev (1834-1907).*
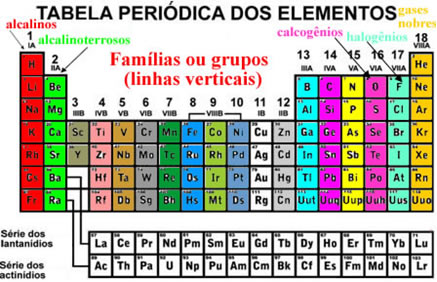
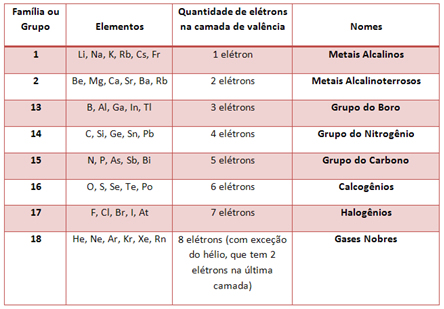
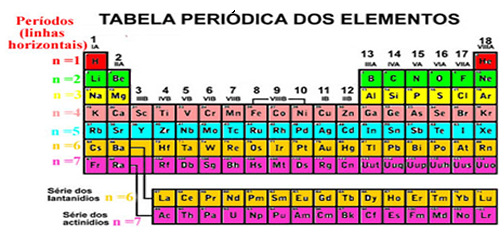
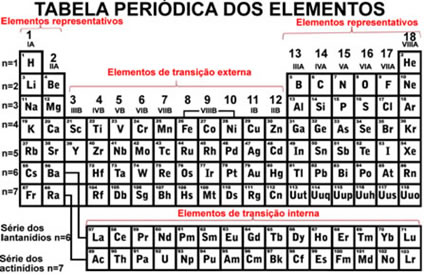
Click Aki >>>TABELA PERIÓDICA COMPLETA INTERATIVA
Vídeo: Tabela periódica
Ligações Químicas
As ligações químicas são feitas pelos átomos para que estes possam se tornar estáveis. Para que os átomos possam se ligar, é necessário que eles envolvam seus elétrons da camada de valência, seja doando-os para outro átomo, como no caso da ligação iônica, seja compartilhando-os com outro átomo, como no caso da ligação covalente. Há também uma terceira modalidade de ligação química, específica para os átomos metálicos, cujo nome é ligação metálica.
De acordo com a ligação química realizada é que podemos classificar as substâncias. Os compostos iônicos são formados pelas ligações iônicas, as moléculas são formadas pelas ligações covalentes e os metais são formados pelas ligações metálicas. Elas também diferem quanto à força: a ligação metálica é mais forte, sendo sucedida pela ligação iônica e então a covalente.
Resumo sobre as ligações químicas
Átomos se ligam para adquirir maior estabilidade química.
A regra do octeto é uma teoria para determinar quando um átomo se torna estável.
Segundo a regra do octeto, um átomo se estabiliza ao ter oito elétrons na camada de valência ou adquirir a mesma configuração eletrônica do gás nobre mais próximo na Tabela Periódica.
A ligação iônica ocorre quando um átomo doa elétrons para outro átomo.
A ligação covalente ocorre quando átomos compartilham pares de elétrons.
Elétrons livres mantêm íons metálicos unidos na ligação metálica, de acordo com a teoria do mar de elétrons.
Regra do Octeto
Como mencionado, as ligações químicas são feitas pelos átomos para que estes possam se tornar estáveis, mas o que de fato significa um átomo ser estável? Existem diversas regras desenvolvidas para que se possa explicar a estabilidade das espécies atômicas, e uma delas é a regra do octeto.
A regra do octeto tem esse nome, pois se baseia na configuração eletrônica dos gases nobres, já que, à exceção do elemento hélio, todos eles possuem oito elétrons na camada de valência. Vejamos o caso dos quatro primeiros gases nobres: hélio (He), neônio (Ne), argônio (Ar) e criptônio (Kr).
2He - 1s2
10Ne - 1s2 2s2 2p6
18Ar - 1s2 2s2 2p6 3s2 3p6
36Kr - 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6
Em suma, pode-se dizer, então, que, pela regra do octeto, um átomo se estabiliza ao adquirir oito elétrons na camada de valência ou quando adquire a configuração eletrônica do gás nobre mais próximo a ele na Tabela Periódica.
Ligação iônica
A ligação iônica ocorre quando um átomo doa elétrons para outro átomo. O átomo que doa é sempre uma espécie de baixa energia de ionização, ou seja, perde elétrons com mais facilidade; já o átomo que recebe é sempre uma espécie de alta afinidade eletrônica, ou seja, tem mais facilidade em receber elétrons. Os elétrons doados e recebidos são sempre os da camada de valência, que, por ser a camada mais externa, é a que sofre menos atração pelo núcleo atômico. Por causa dessa harmonia é que a ligação iônica é considerada uma ligação forte.
Como, em geral, os metais são espécies de baixa energia de ionização e os ametais são espécies de alta afinidade eletrônica, muitos identificam que a ligação iônica ocorre sempre entre um metal e um ametal.
Exemplo 1:
Um exemplo clássico de ligação iônica é a que ocorre entre o sódio (Na) e o cloro (Cl).
O átomo de sódio possui número atômico igual a 11, logo, possui 11 prótons. Como todo átomo é uma espécie eletricamente neutra, o átomo de sódio também possui 11 elétrons, assim, sua distribuição eletrônica é: 1s2 2s2 2p6 3s1.
A camada de valência do sódio é a que contém o subnível 3s1, e, caso ele perca esse elétron, terá uma nova camada de valência — 2s2 2p6 —, que já possui oito elétrons e, por isso, faria-o estável.
Já o cloro é um átomo que possui número atômico igual a 17, logo, possui 17 prótons. Mais uma vez, por ser uma espécie eletricamente neutra, o átomo de cloro também possui 17 elétrons. Sua distribuição eletrônica é, então: 1s2 2s2 2p6 3s2 3p5.
Como se vê, a camada de valência do cloro é a que contém os subníveis 3s2 e 3p5 (com sete elétrons), e, nesse caso, o cloro precisa de apenas um elétron a mais nessa camada para adquirir oito elétrons nela e então se estabilizar. Por isso, sódio e cloro se ligam, pois o sódio doa o elétron para o cloro, conforme o esquema abaixo mostra:
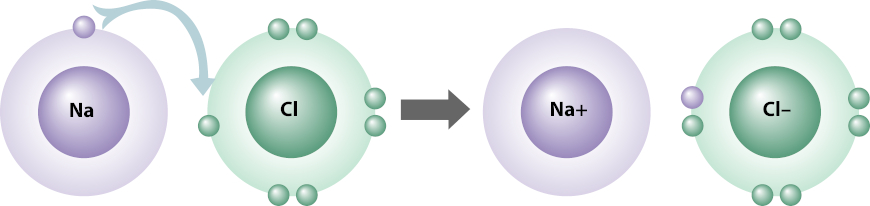
Ao demonstrarmos uma ligação iônica, não há a necessidade de representar todos os elétrons de cada átomo, mas apenas os elétrons de valência. A utilização de setas é comum e recomendada para que se mostre a espécie que doa e a espécie que recebe o(s) elétron(s).
Como o sódio perde um único elétron, ele se torna um cátion (íon positivo), Na+. Já o cloro, como recebe um elétron, torna-se um ânion (íon negativo), Cl–.
O composto gerado, NaCl, é chamado de cloreto de sódio e é o sal de cozinha, um tempero amplamente utilizado. Na sua forma sólida, como comumente conhecemos, o cloreto de sódio tem uma estrutura espacial muito bem definida, em que os íons de sódio e cloro se alternam, estabilizando a estrutura, uma vez que possuem cargas opostas.
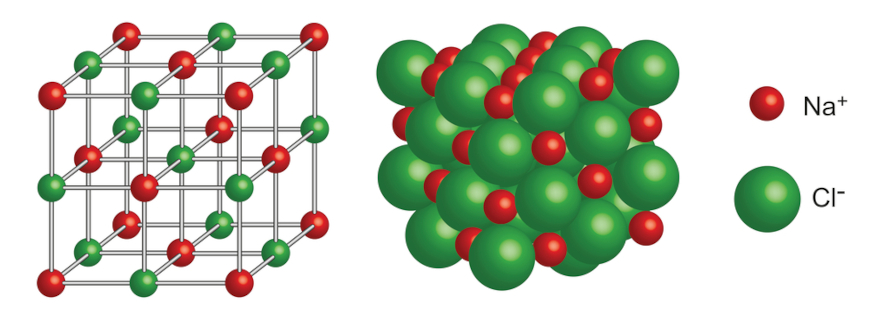
Outra forma de identificarmos se um composto é iônico é pela diferença dos valores de eletronegatividade de cada átomo participante do composto. Caso essa diferença seja maior que 1,70, nós dizemos que esse composto é iônico.
Por exemplo, a eletronegatividade do sódio é de 0,93, enquanto a eletronegatividade do cloro é de 3,16. Se fizermos a diferença, temos que:
3,16 – 0,93 = 2,23
Como 2,23 é maior que 1,70, podemos afirmar que o cloreto de sódio é um composto iônico.
Exemplo 2:
Veja outro exemplo de ligação iônica, entre o metal alcalinoterroso cálcio (Z = 20) e o halogênio flúor (Z = 9).
- Distribuição eletrônica do cálcio: 1s2 2s2 2p6 3s2 3p6 4s2 → Precisa perder dois elétrons para se estabilizar.
- Distribuição eletrônica do flúor: 1s2 2s2 2p5 → Precisa ganhar um elétron para se estabilizar.
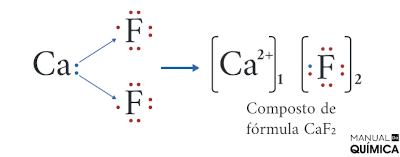
Perceba nesse exemplo que, como o cálcio precisa perder dois elétrons, um átomo de flúor não é suficiente (pois o flúor só necessita de um elétron para se estabilizar), dessa forma, são necessários dois átomos de flúor para que o composto se torne estável.
O cálcio possui uma eletronegatividade de 1,00, enquanto a eletronegatividade do flúor é de 3,98. Assim, a diferença entre as eletronegatividades é de 2,98, que é um valor maior que 1,70, confirmando que se trata de um composto iônico.
Veja também: Como realizar a distribuição eletrônica de íons?
Ligação covalente
A ligação covalente ocorre quando os átomos compartilham entre si os seus elétrons. Diferentemente da ligação iônica, na ligação covalente os átomos envolvidos não possuem características antagônicas, mas sim semelhantes.
Percebe-se que a ligação covalente ocorre entre átomos de ametais, que são espécies que possuem alta energia de ionização (não perdem elétrons com facilidade) e alta afinidade eletrônica (mais facilidade em receber elétrons). Como os átomos envolvidos possuem características semelhantes e necessitam simultaneamente ganhar elétrons para se estabilizar, o que ocorre é um compartilhamento dos elétrons das camadas de valência para estabilizar a espécie gerada, a qual é chamada de molécula.
Exemplo 1:
Vejamos o caso da molécula de água, cuja fórmula é H2O.
- Distribuição eletrônica do hidrogênio (H, Z = 1): 1s1 → Precisa ganhar um elétron para se estabilizar.
- Distribuição eletrônica do oxigênio (O, Z = 8): 1s2 2s2 2p4 → Precisa ganhar dois elétrons para se estabilizar.
Nesse caso, como podemos ver logo abaixo, o oxigênio compartilha dois dos seus seis elétrons de valência com o único elétron de valência de cada átomo de hidrogênio. Assim, os pares de elétrons gerados são compartilhados entre o oxigênio e os respectivos átomos de hidrogênio. Consideramos, então, que o oxigênio fica com oito elétrons (seus seis originais, mais os dois adquiridos através dos hidrogênios no compartilhamento) e cada hidrogênio fica com dois elétrons (seu elétron original, mais o elétron adquirido no compartilhamento com o oxigênio).
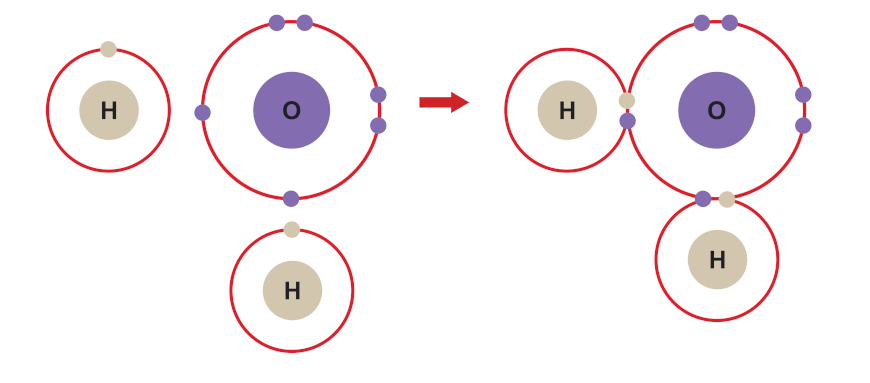
O composto covalente (ou molécula) formado é geralmente representado por uma fórmula estrutural característica, como a que se segue:

Nessa notação, cada par de elétrons compartilhado entre os átomos é substituído por uma barra. Alguns autores também decidem representar os pares de elétrons não ligantes, ou seja, os que não fazem nenhuma ligação covalente, com pequenas esferas sobre o átomo a que eles pertencem.
Também é possível que os átomos compartilhem mais de um par de elétrons, podendo chegar, na verdade, a três pares de elétrons compartilhados entre os mesmos átomos.
Exemplo 2:
Veja o caso do CO2, comumente chamado de gás carbônico.
- Distribuição eletrônica do carbono (C, Z = 6): 1s2 2s2 2p2 → Precisa ganhar quatro elétrons para se estabilizar.
- Distribuição eletrônica do oxigênio (O, Z = 8): 1s2 2s2 2p4 → Precisa ganhar dois elétrons para se estabilizar.
Cada átomo de oxigênio, nessa estrutura, compartilha seus dois elétrons de valência com dois dos quatro elétrons de valência do carbono, estabelecendo o que nós chamados de uma ligação covalente dupla. Assim, consideramos que cada átomo de oxigênio pode considerar mais dois elétrons na sua estrutura e que o carbono pode considerar mais quatro elétrons na sua estrutura.
![]()
Exemplo 3:
O gás nitrogênio, N2, é um exemplo em que três pares de elétrons são compartilhados entre os mesmos átomos.
- Distribuição eletrônica do nitrogênio (N, Z = 7): 1s2 2s2 2p3 → Precisa ganhar três elétrons para se estabilizar.
Cada átomo de nitrogênio utiliza três dos seus cinco elétrons de valência para estabelecer uma ligação covalente tripla, como mostra a estrutura a seguir.
![]()
Outra forma de identificar se uma substância é covalente é pela diferença de eletronegatividade dos átomos. No caso dos compostos covalentes, a diferença entre os valores de eletronegatividade deve ser menor que 1,70. No caso da água, o hidrogênio possui eletronegatividade igual a 2,20 e o oxigênio possui eletronegatividade igual a 3,44. A diferença, então, será:
3,44 – 2,20 = 1,24
Como 1,24 é menor que 1,70, podemos confirmar que a água se trata de um composto covalente.
Exemplo 4:
Quando um átomo já completou o octeto, mas ainda precisa fazer ligações covalentes, podemos estabelecer o compartilhamento usando elétrons de valência de apenas um átomo e não de dois, como tradicionalmente ocorre. É o caso do SO2.
Tanto o enxofre quanto o oxigênio possuem seis elétrons na camada de valência, ou seja, ambos precisam ganhar dois elétrons para se estabilizar. Nesse caso, o enxofre compartilha dois de seus elétrons de valência com outros dois elétrons de valência de um dos átomos de oxigênio. Ao fazer isto, tanto o oxigênio quanto o enxofre adquirem oito elétrons na camada de valência.
Para que se possa ligar o outro átomo de oxigênio, a nova ligação formada possui apenas a participação dos elétrons de valência do enxofre, sem mobilizar os elétrons de valência do outro átomo de oxigênio. Assim, todos os átomos ficam com oito elétrons na camada de valência e obedecem aos critérios da regra do octeto.

Alguns autores costumam chamar essa ligação covalente, em que se mobiliza apenas o par de elétrons de um átomo, de ligação covalente dativa ou ligação covalente coordenada, representando-a com uma seta.
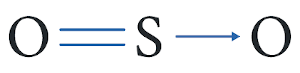
Leia também: Como ocorre a alotropia do enxofre?
Exceções à regra do octeto
Alguns compostos covalentes acabam sendo exceções à regra do octeto, o que quer dizer que alguns dos átomos desses compostos não se estabilizam com oito elétrons na camada de valência, mas com menos ou mais que oito elétrons.
Os átomos de boro (B) e berílio (Be) são casos de elementos que se estabilizam com menos que oito elétrons. Frequentemente percebemos o berílio se estabilizando com quatro elétrons na camada de valência, como no caso do BeH2, e o boro se estabilizando com seis elétrons na camada de valência, como é o caso do BH3.
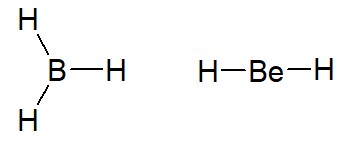
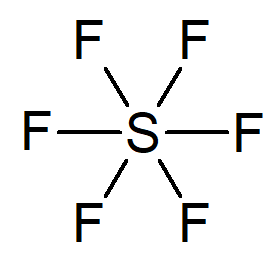
Já o enxofre, no composto SF6, faz o que chamamos de expansão do octeto, ou seja, estabiliza-se com mais de oito elétrons na camada de valência (no caso, 12 elétrons).
A molécula do NO2 traz outra exceção interessante à regra do octeto. Nessa molécula, podemos considerar a presença de um elétron desemparelhado, ou seja, um elétron não ligante isolado, sem ter outro elétron para fazer um par. Isso pode ocorrer quando o somatório dos elétrons de valência dos átomos da molécula for ímpar. No NO2, o nitrogênio tem cinco elétrons de valência e cada oxigênio tem seis, logo, o somatório é igual a 17 elétrons.

Por conta dessas falhas da regra do octeto, alguns livros trazem teorias mais modernas para explicar de forma única a formação dos compostos, entretanto, tal discussão foge das necessidades de conhecimento do ensino básico.
Ligação metálica
Os metais, como mencionado, são espécies químicas que possuem uma baixa energia de ionização, o que quer dizer que perdem elétrons de valência com facilidade. Com base nessa propriedade, cientistas desenvolveram a teoria do mar de elétrons para justificar a ligação entre átomos de um determinado metal.
Segundo essa teoria, os átomos do metal estariam em posições bem definidas com seus elétrons de valência totalmente livres pela estrutura. Assim, os metais estariam com uma carga positiva e sendo estabilizados por esse amontoado de elétrons livres, de carga negativa, dando a sensação de que os cátions metálicos estariam submersos em um mar de elétrons.
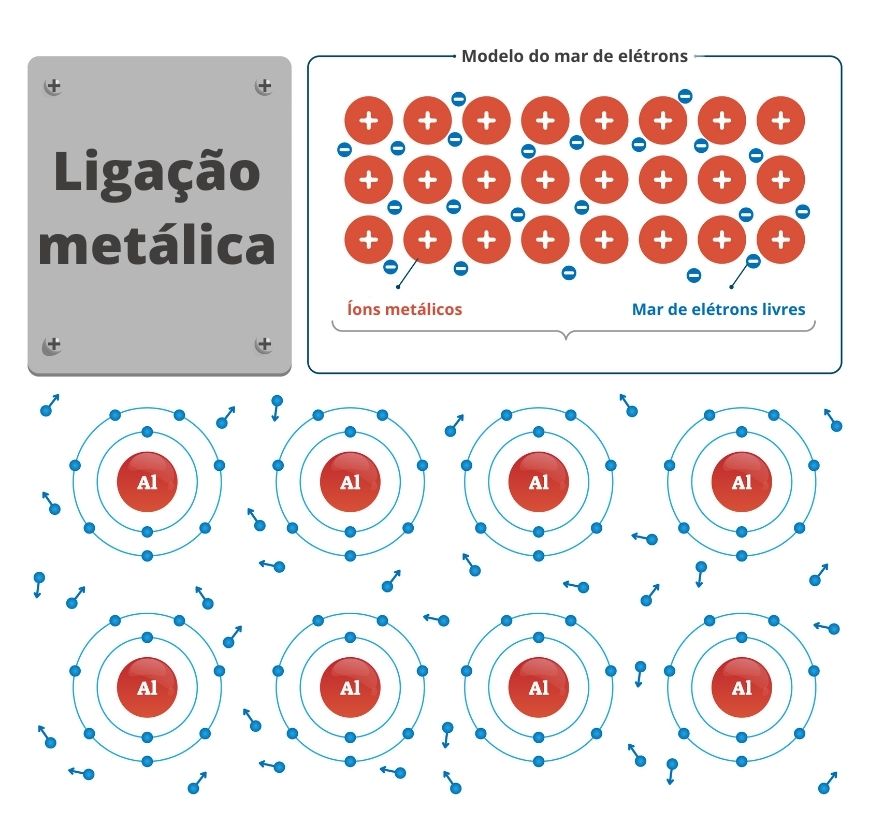
Assim como a presença dos elétrons entre dois átomos os mantém unidos numa ligação covalente, a presença dos elétrons livres nesse mar de elétrons é que mantém os átomos metálicos unidos, no que conhecemos como ligação metálica.
Entretanto, vale salientar que, nesse modelo de ligação metálica, os átomos dos metais não obedecem à regra do octeto.
A teoria do mar de elétrons serve para explicar o porquê dos metais conduzirem corrente elétrica no estado sólido. Sabe-se que corrente elétrica é o mesmo que cargas em movimento, em um fluxo ordenado. Como o elétron é uma carga elétrica, ao se aplicar uma diferença de potencial, ele pode manter um fluxo pela estrutura do metal, uma vez que está livre para se movimentar. Esse movimento dos elétrons é, então, a corrente elétrica que o metal conduz.
Apesar de explicar alguns comportamentos dos compostos metálicos, a teoria do mar de elétrons já foi refutada por teorias mais modernas, porém também mais complexas, as quais envolvem conhecimentos prévios de mecânica quântica e não são debatidas no ensino básico.
Adaptado de: COLÉGIO NOSSA SENHORA DE LOURDES
https://www.manualdaquimica.com/quimica-geral/ligacoes-quimicas.htm
Vídeo; Ligações Químicas
Biotecnologia
A biotecnologia é uma área que visa desenvolver produtos e processos biológicos com a ajuda da ciência e da tecnologia. A Organização das Nações Unidas (ONU) classifica biotecnologia como “qualquer aplicação tecnológica que utiliza sistemas biológicos, organismos vivos, ou seres derivados, para fabricar ou modificar produtos ou processos para utilização específica”.
A biotecnologia abrange diferentes áreas do conhecimento que incluem a ciência básica (como biologia molecular, microbiologia, etc.), a ciência aplicada (como técnicas imunológicas, químicas e biológicas) com tecnologias diversas (como informática, robótica e controle de processos).
O profissional de biotecnologia é multidisciplinar, pois entende de todas – ou quase todas – as áreas citadas. Seu alvo é sempre melhoramento genético, criação e gerenciamento de novos produtos como medicamentos, ingredientes para alimentos ou até indivíduos como plantas.
A engenharia genética ocupa uma posição de destaque nessa área como tecnologia inovadora por permitir subsidiar métodos tradicionais de produção ou por permitir a obtenção de produtos inteiramente novos como os transgênicos. A biotecnologia age como uma ferramenta inovadora da vida cotidiana com impactos em vários setores produtivos e oferecendo desenvolvimento para várias nações.
Uma aplicabilidade constante da biotecnologia é na indústria:
- Indústria farmacêutica: desenvolvimento de novas drogas, produção e melhoramento de antibióticos, vacinas, estabelecimentos de terapias gênicas e demais projetos para tratamentos de doenças em animais e plantas;
- Indústrias de análises: desenvolvimento de testes de diagnósticos clínicos. Alimentícios agrícolas e ambientais;
- Indústria da agricultura: desenvolvimento de uma gama de variedades de remédios para plantas, sementes mais resistentes a pragas e condições climáticas, pesticidas menos impactantes para a saúde humana e ambiental etc;
- Indústria alimentícia: produção, controle e melhoramento de alimentos e bebidas;
- Indústria química: produção de insumos químicos, enzimas e proteínas recombinantes;
Mercado de trabalho
A demanda por bacharéis e tecnólogos em biotecnologia só aumenta visto o desejo constante das nações em se desenvolver para enfrentar desafios como a maior produção de alimentos, as constantes epidemias, as mutações de vírus e bactérias que antes estavam controladas, a necessidade do mercado por produtos menos impactantes e mais fortes etc.
Além disso, outras áreas que utilizam a biotecnologia, como os cosméticos, estão crescendo muito principalmente no Brasil. Uma série de produtos para cabelo e pele, além de maquiagens, aparecem todos os anos com propostas cada vez mais interessantes de tratamento de beleza sem cirurgias. Para isso, as empresas privadas investem pesado em profissionais de biotecnologia.
Referências bibliográficas:
https://web.archive.org/web/20160424065404/http://guiadoestudante.abril.com.br:80/profissoes/meio-ambiente-ciencias-agrarias/biotecnologia-602879.shtml
https://web.archive.org/web/20190817232240/http://www.ort.org.br:80/biotecnologia/o-que-e-biotecnologia/



Nenhum comentário:
Postar um comentário